Aktuelle Publikationen
Patrick Probst, Moritz Lindemann, Johanna R. Bruckner, Boshra Atwi, Dongren Wang, Felix R. Fischer, Marc Högler, Matthias Bauer, Niels Hansen, Michael Dyballa und Michael R. Buchmeiser*
The cationic molybdenum alkylidyne N-heterocyclic carbene (NHC) complex [Mo(C-p-OMeC6H4)(OCMe(CF3)2)2 (IMes)][B(ArF4] (IMes = 1,3-dimesitylimidazol-2-ylidene) was selectively immobilized inside the pores of ordered mesoporous silica (OMS) with pore diameters of 66, 56, and 28 Å and used in the ring-expansion metathesis polymerization (REMP) of cyclic olefins to yield cyclic polymers. A strong confinement effect was observed for cis-cyclooctene (cCOE), 1,5-cyclooctadiene (COD), (+)-2,3-endo,exo-dicarbomethoxynorborn-5-ene ((+)-DCMNBE), and 2-methyl-2-phenylcycloprop-1-ene (MPCP), allowing for the synthesis of low-molecular-weight cyclic polymers even at a high monomer concentration. The exclusive formation of cyclic polymers was demonstrated by matrix-assisted laser desorption ionization time-of-flight (MALDI-TOF) mass spectrometry. Confinement also influences stereoselectivity, resulting in a pronounced increase in Z-selectivity and in an increased cis-syndiospecificity.
Weitere Informationen erhalten Sie von:
Prof. Michael R. Buchmeiser
Institut für Polymerchemie
Universität Stuttgart
von Kristof M. Altus, Yiping Shi, Patrick Probst, Jack H. Heaton, Matthew R. Gyton, Leonardo Lari, Michael R. Buchmeiser*, Philip W. Dyer*, Andrew S. Weller*
A tandem catalytic ensemble of solid-state molecular organometallic (SMOM) crystalline pre-catalysts are deployed under batch or flow conditions for the ethene to propene process (ETP). These catalysts operate at ambient temperature and low pressure, via sequential ethene dimerization, butenes isomerization and cross-metathesis. Under flow conditions the on-stream ethene conversion (55 %), initial propene selectivity (92 %), stability (71 % selectivity after 7 h) and low temperature/pressures are competitive with the best-in-class heterogeneous systems, marking a new, in crystallo, approach to ETP.
Weitere Informationen erhalten Sie von:
Prof. Michael R. Buchmeiser
Institut für Polymerchemie
Universität Stuttgart
Koushani Kundu, Severin Haid, Moritz R. Schäfer, Wolfgang Frey, Johannes Kästner* und Michael R. Buchmeiser*
Stereoselective ring opening metathesis polymerization (ROMP) of enantiomerically pure 2,3-dicarbomethoxynorborn-5-ene ((+)-DCMNBE) was accomplished by the action of cationic tetra- and pentacoordinated molybdenum imido alkylidene cyclic alkyl amino carbene (CAAC) complexes that are chiral at molybdenum. The same catalysts were also utilized to perform the ROMP of 2,3-dimethoxymethylnorborn-5-ene ((+)-DMMNBE). All complexes were moderately to highly active and showed high trans-isoselectivity, offering up to 97% trans-isotactic (it) repeat units. In all cases, tetracoordinated complexes were the active species, resulting in pentacoordinated transition states. A theoretical model was elaborated using the buried volume (% Vbur) values of all ligands from single-crystal X-ray analysis together with the structures of the density functional theory (DFT) generated molybdacyclobutane intermediates. The model demonstrates the steric effects of all ligands at molybdenum on the trans-isoselectivity of the reaction, as predicted by the turnstile mechanism, and includes a positive correlation between the bulky CAAC ligand with high values of % Vbur of the other ligands and a high trans-isoselectivity. It was also successfully extended to molybdenum imido alkylidene N-heterocyclic carbene (NHC) complexes, proved to be of sufficient accuracy with a root mean squared error (RMSE) of 6.19% and was verified by Monte Carlo cross-validation (MCCV).
Weitere Informationen erhalten Sie von:
Prof. Michael R. Buchmeiser
Institut für Polymerchemie
Universität Stuttgart
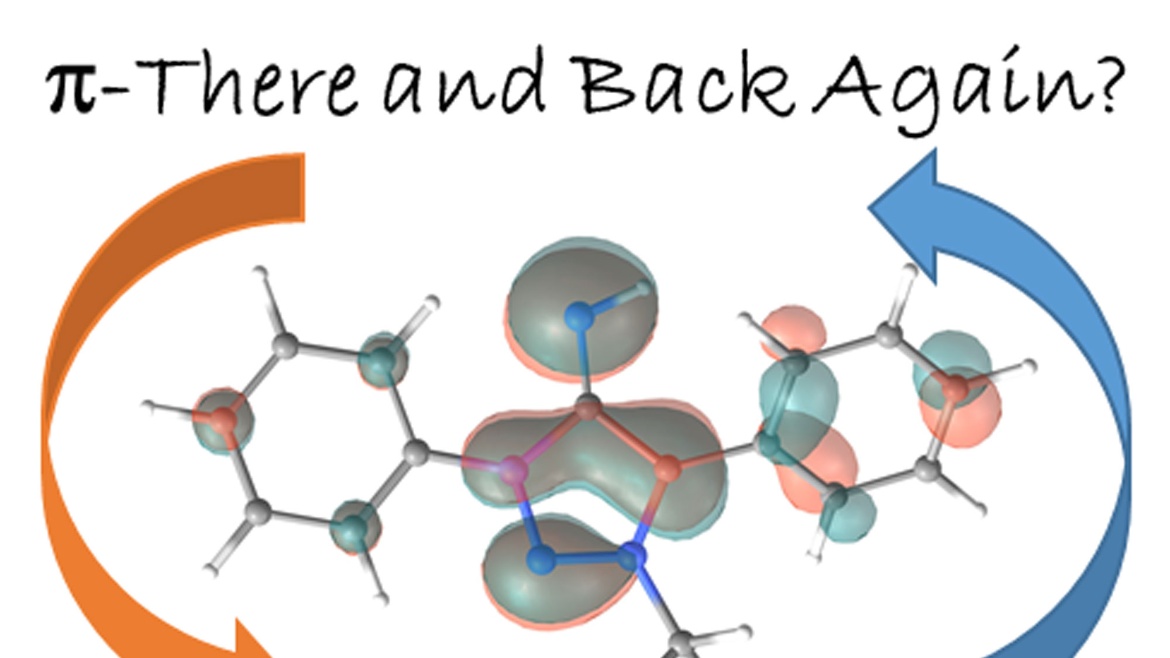
von Nicholas Birchall, Fridolin Hennhöfer, Martin Nieger, Dietrich Gudat
A chromium complex carrying two benzanellated N-heterocyclic phosphenium (bzNHP) ligands was prepared by a salt metathesis approach. Spectroscopic studies suggest that the anellation enhances the π-acceptor ability of the NHP-units, which is confirmed by the facile electrochemical reduction of the complex to a spectroscopically characterized radical anion. Co-photolysis with H2 allowed extensive conversion into a σ-H2-complex, which shows a diverse reactivity towards donors and isomerizes under H−H bond fission and shift of a hydride to a P-ligand. The product carrying phosphenium, phosphine and hydride ligands was also synthesized independently and reacts reversibly with CO and MeCN to yield bis-phosphine complexes under concomitant Cr-to-P-shift of a hydride. In contrast, CO2 was not only bound but reduced to give an isolable formato complex, which reacted with ammonia borane under partial recovery of the metal hydride and production of formate. Further elaboration of the reactions of the chromium complexes with CO2 and NH3BH3 allowed to demonstrate the feasibility of a Cr-catalyzed transfer hydrogenation of CO2 to methanol. The various complexes described were characterized spectroscopically and in several cases by XRD studies. Further insights in reactivity patterns were provided through (spectro)electrochemical studies and DFT calculations.
Chem. Eur. J. 2024, 30, e202401714
Weitere Informationen erhalten Sie von:
Prof. Dietrich Gudat
Institut für Anorganische Chemie
Universität Stuttgart
von Andreas Schneider, Thomas B.. Lystbænk, Daniel Markthaler, Niels Hansen und Bernhard Hauer
Terpene synthesis is at the heart of organic synthesis and often represents the state-of-the-art in synthetic methodologies. A remaining challenge is the correct three-dimensional assembly of the terpene skeleton via cationic cyclization of abundant linear precursors. Nature has been using this strategy for eons by employing the catalytic excellence of terpene cyclases. In this paper, we harness the synthetic power of engineered squalene-hopene cyclases and demonstrate the chemoenzymatic synthesis of ten chiral (mero-)terpenes with up to five stereocenters and >99% ee and de.
Nature communications, 2024, doi 10.1038/s41467/-024-448993
Weitere Informationen erhalten Sie von:
Prof. Bernhard Hauer
Institut Biochemie und Technische Biochemie,
Abteilung Technische Biochemie
Universität Stuttgart
von Yannick Stöckl*, Katrin Gugeler, Celine M. Holzwarth, Wolfgang Frey, Sascha Wegner, Birgit Claasen, Anna Zens, Dietrich Gudat, Christian P. Sindlinger, Johannes Kästner*, und Sabine Laschat
Organometallics 2024, 43, 3, 330–340.
Enantioenriched boron chelates show promising synthetic and luminescent properties; however, the challenging synthesis makes these compounds scarce. In our earlier work, we established a chirality transfer from boron O,N-chelates toward enantioenriched C,N-chelates. This methodology proved to be quite robust, in terms of yields and selectivity. However, unexpected steric effects on stereocontrol prompted a deeper investigation of the chirality transfer. In order to gain a holistic understanding of this process, we studied the structure of the O,N- and C,N-chelates as well as the stability of the dative B–N bonds. Furthermore, the proposed ate-complex as a reaction intermediate could be characterized using heteronuclear (2D) NMR spectroscopy. For this ate-complex, a tridentate O,N,N-chelate effect of the borate anion with the Li-cation was observed. Additional experiments indicated that the borate formation governs the stereoselectivity of chirality transfer. For a successful chirality transfer, an unprecedented SN2-type breaking of the dative B–N bond with an organometallic nucleophile was identified by DFT calculations as the most likely reaction path. For other cases, decreased or inverse enantioselectivity was rationalized by a solvent-assisted pathway.
Weitere Informationen erhalten Sie von:
Prof. Sabine Laschat
Institut für Organische Chemie
Universität Stuttgart
von Jan S. Florenski, Noah Schellander, Prof. Dr.-Ing. Elias Klemm
ChemCatChem 2024, e202301
Weitere Informationen erhalten Sie von:
Prof. Elias Klemm
Institut für Technische Chemie
Universität Stuttgart
Terpene können durch Brønsted- und Lewis-Säuren isomerisiert werden, wobei schwer zu trennende Produktgemische entstehen. Uns ist es nun gelungen eine Variante des Enzyms Squalen-Hopen-Zyklasen zu entwickeln, die die schwierige Isomerisierung mit bisher unerreichter Präzision katalysiert. Wir zeigen, wie die fein justierte Kontrolle des Carbo-Kations im Enzym, die (+)-Borneol-Selektivität von 1% auf >90% (>99% de) steigern lässt. In Zusammenarbeit mit der Arbeitsgruppe von Silvia Osuna, Univ. Girona deuten unsere kombinierten experimentellen und rechnerischen Daten darauf hin, dass die Orientierung wichtiger aromatischer Reste zu einer Umstrukturierung des Wassernetzwerks führt, die die selektive Terminierung des sekundären Isobornyl-Kations erleichtert. Diese Arbeit erweitert unser mechanistisches Verständnis von Carbo-Kation-Umlagerungen und schafft die Voraussetzungen für eine zielgerichtete Reorganisation des Gerüsts von weit verbreiteten Terpenen.
von Julian Ludwig, Christian Curado-Carballada, Stephan C. Hammer, Andreas Schneider, Svenja Diether, Nico Kress, Sergi Ruiz-Barragán, Sílvia Osuna* und Bernhard Hauer*
Weitere Informationen erhalten Sie von:
Prof. Bernhard Hauer
Institut Biochemie und Technische Biochemie,
Abteilung Technische Biochemie
Universität Stuttgart
Hydrido-closo-Borate mit nicht-klassischen Wasserstoffbrückenbindungen zwischen den hydridischen Wasserstoffatomen der Boratanionen und den protonischen Wasserstoffatomen von Ammoniak- oder Hydrazinmolekülen bzw. Ammonium- oder Hydraziniumkationen gemäß B–Hδ–··· Hδ+–N, die als sogenannte "dihydrogen bonds" präformierte Reaktionspfade zur irreversiblen Abspaltung von elementarem Wasserstoff (H2) angesehen werden können, stellen bemerkenswert leichte Wasserstoffspeicher dar. Allen voran seien hier Verbindungen, wie etwa (NH4)2[BnHn], (N2H5)2[BnHn] und (N2H5)2[BnHn] · 2 N2H4 mit n = 10 und 12 genannt, deren thermischer Abbau zu Bornitrid und amorphem Bor sowie großen Mengen an Wasserstoff führt.
Der jüngste Bericht hierzu findet sich in L. W. Zimmermann, R. Aghaei Hakkak, M. Ranjbar, Th. Schleid: "Crystal Structures and Thermal Analyses of Three New High-Energy Hydrazinium Hydro-closo-Borates", Int. J. Hydrog. Energy 2024, 49, 1469–1477.
Weitere Informationen erhalten Sie von
Prof. Thomas Schleid
Institut für Anorganische Chemie
Universität Stuttgart
Ältere Publikationen
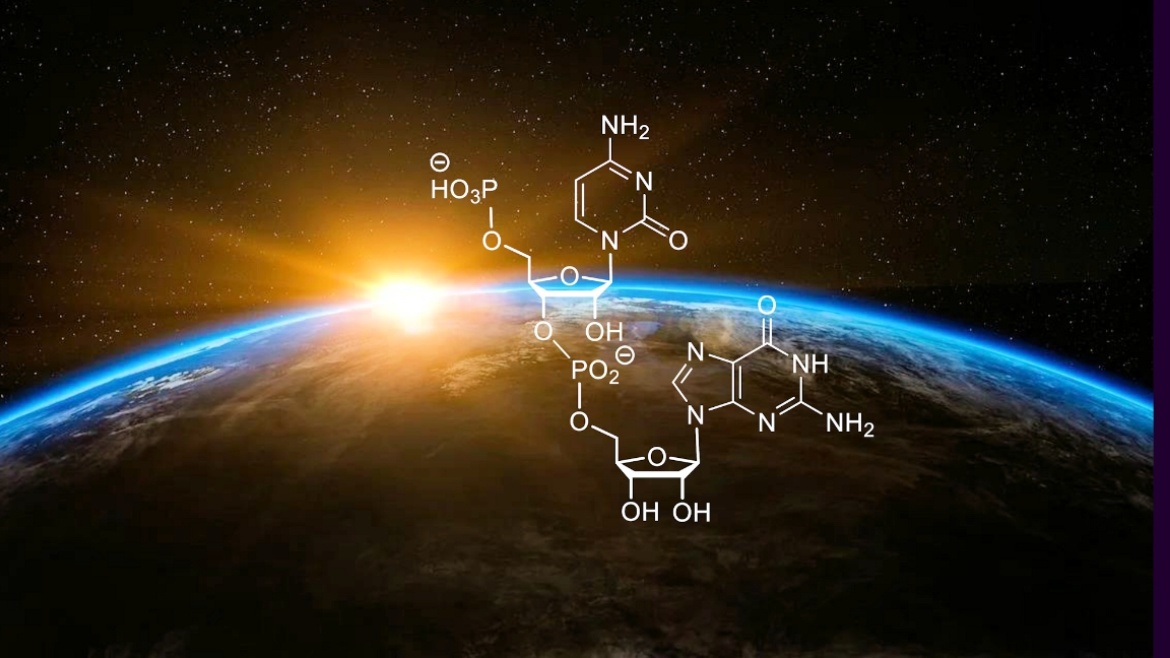
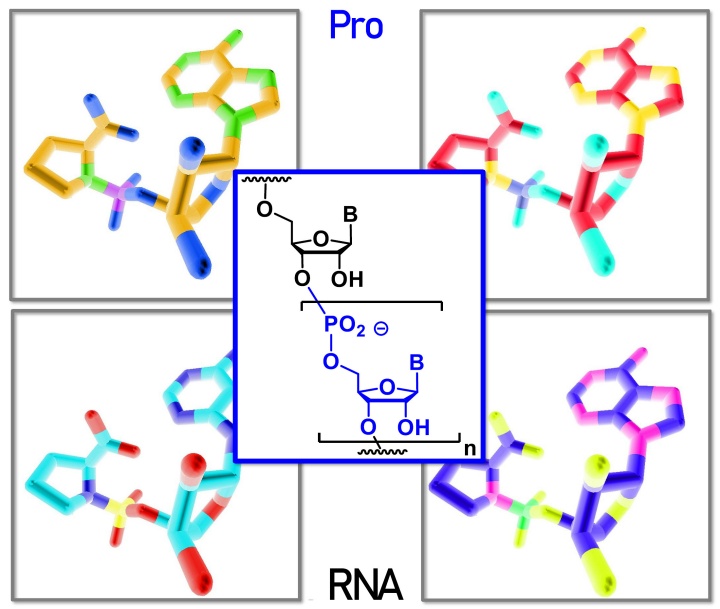
In der Zeitschrift Angewandte Chemie ist eine Publikation der Arbeitsgruppe von Prof. Clemens Richert erschienen. Im Rahmen eines Projektes des Transregio-Sonderforschungsbereiches 235 konnte nachgewiesen werden, dass die Aminosäure Prolin und Einzelbausteine der RNA zu Verbindungen reagieren, die als Ausgangsmaterial für das enzymfreie genetische Kopieren von RNA-Sequenzen agieren. Diese bisher unbekannte Synergie zwischen den Bausteinen von Eiweißen und genetischem Material hilft den molekularen Ursprung des Lebens zu erklären.
Lesen Sie hier die Mitteilung auf der Homepage des Instituts
bzw. auf der Homepage des SFBs 235
Weitere Informationen erhalten Sie von:
Prof. Clemens Richert
Institut für Organische Chemie
Universität Stuttgart
von S. Gergel, J. Soler, A. Klein, K. H. Schülke, B. Hauer, M. Garcia-Borràs und S. Hammer.
The direct regioselective oxidation of internal alkenes to ketones poses an important synthetic challenge. Now, directed evolution of a cytochrome P450 enzyme affords a ketone synthase that can efficiently oxidize internal arylalkenes directly to ketones with high chemo- and regioselectivity.
Nature Catalysis 2023
Weitere Informationen erhalten Sie von:
Prof. Bernhard Hauer
Institut Biochemie und Technische Biochemie,
Abteilung Technische Biochemie
Universität Stuttgart
von Benjamin Aberle, Daniel Kowalczyk, Simon Massini, Alexander-N. Egler-Kemmerer, Sebastian Gergel, Stephan Hammer, Bernhard Hauer
Terpenes are natural compounds with diverse applications, but the available carbon scaffolds are limited by their biosynthesis from five carbon precursors. To gain access to non-natural terpenoids, we identified and engineered methyltransferases for late-stage C-methylation of unactivated alkenes. The engineering resulted in a 55-fold improvement of conversion of (E,E)-farnesol with > 99% selectivity. In total, five non-natural terpenoids were produced and isolated using this biocatalytic method. This opens new avenues for the modification of the carbon scaffold of terpenes.
Weitere Informationen erhalten Sie von:
Prof. Bernhard Hauer
Institut Biochemie und Technische Biochemie,
Abteilung Technische Biochemie
Universität Stuttgart
von Andreas Schneider; Christian Curado; Thomas B. Lystbaek; Sílvia Osuna; Bernhard Hauer
Angewandte Chemie: DOI number 10.1002/anie.202301607
The synthetic power of terpene cyclases is of broad academic as well as industrial interest as it can cut down synthetic routes to complex cyclic terpenes to essentially one step. However, these enzymes usually lack catalytic turnovers and stability under the new-to-nature conditions. Teaming up with the BioCompLab, Girona of Silvia Osuna, we showcase the synergy of tailoring the active site and entrance tunnel of the squalene-hopene cyclase for the stereocontrolled cationic cyclization of E,E-homofarnesol to (–)-ambroxide with >100.000 total turnovers.
Weitere Informationen erhalten Sie von:
Prof. Bernhard Hauer
Institut Biochemie und Technische Biochemie,
Abteilung Technische Biochemie
Universität Stuttgart
von Dongyang Chen, Francisco Tenopala-Carmona, Julius A. Knöller, Andreas Mischok, David Hall, Subeesh Madayanad Suresh, Tomas Matulaitis, Yoann Olivier, Pierre Nacke, Frank Gießelmann, Sabine Laschat, Malte C. Gather, Eli Zysman-Colman
The use of thermally activated delayed fluorescence (TADF) emitters and emitters that show preferential horizontal orientation of their transition dipole moment (TDM) are two emerging strategies to enhance the efficiency of OLEDs. We present the first example of a liquid crystalline multi-resonance TADF (MR-TADF) emitter, DiKTa-LC. The compound possesses a nematic liquid crystalline phase between 80 °C and 110 °C. Importantly, the TDM of the spin-coated film shows preferential horizontal orientation, with an anisotropy factor, a, of 0.28, which is preserved in doped poly(vinylcarbazole) films. Green-emitting (λEL = 492 nm) solution-processed OLEDs based on DiKTa-LC showed an EQEmax of 13.6%. We thus demonstrate for the first time how self-assembly of a liquid crystalline TADF emitter can lead to the so-far elusive control of the orientation of the transition dipole in solution-processed films, which will be of relevance for high-performance solution-processed OLEDs.
Angew. Chem. Int. Ed. 2023, e202218911.
Weitere Informationen erhalten Sie von:
Prof. Sabine Laschat
Institut für Organische Chemie
Universität Stuttgart
von Shubhadeep Chandra, Dr. Arijit Singha Hazari, Dr. Qian Song, David Hunger, Dr. Nicolás. I. Neuman, Prof. Dr. Joris van Slageren, Prof. Dr. Elias Klemm, Prof. Dr. Biprajit Sarkar.
Weitere Informationen erhalten Sie von:
Prof. Biprajit Sarkar
Institut für Anorganische Chemie
Universität Stuttgart
von Simon Suhr, Robert Walter, Julia Beerhues, Uta Albold und Biprajit Sarkar
Weitere Informationen erhalten Sie von:
Prof. Biprajit Sarkar
Institut für Anorganische Chemie
Universität Stuttgart
von Richard Rudolf, Nicolás I. Neuman, Robert R. M. Walter, Mark R. Ringenberg und Biprajit Sarkar
Angew. Chemie 2022, 61, e202200653
Weitere Informationen erhalten Sie von:
Prof. Biprajit Sarkar
Institut für Anorganische Chemie
Universität Stuttgart
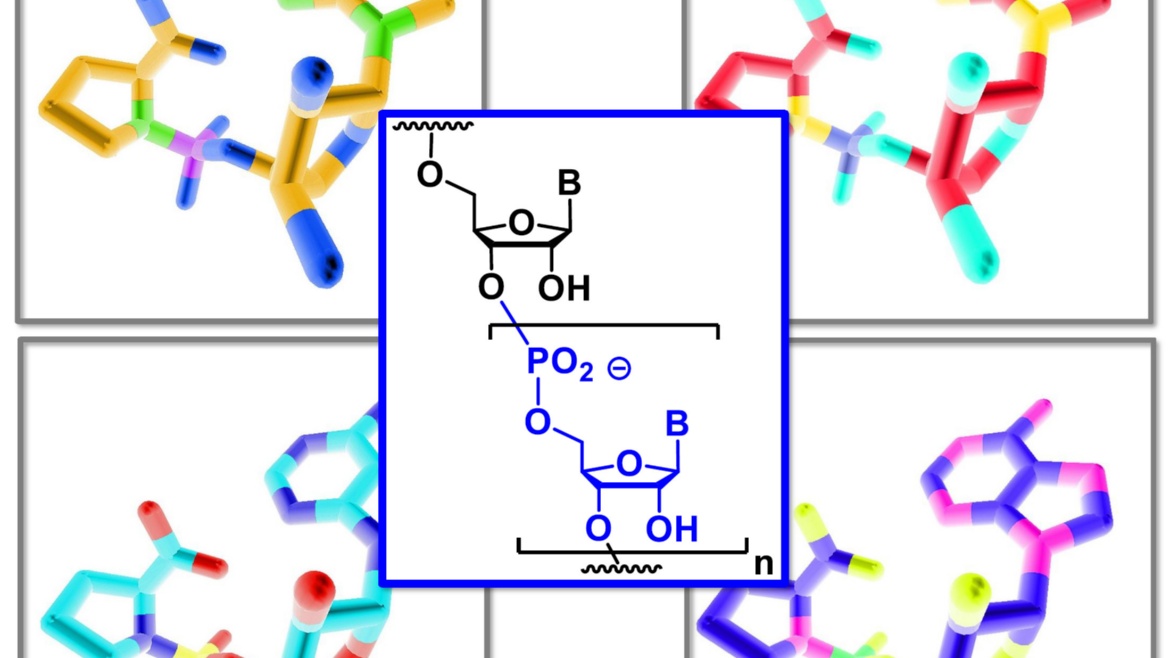
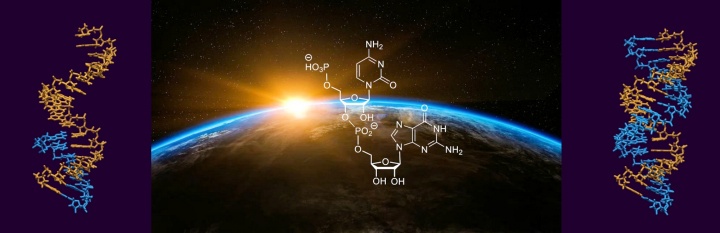
von Gabrielle Leveau, Daniel Pfeffer, Bernhard Altaner, Eric Kervio, Franziska Welsch, Ulrich Gerland und Clemens Richert
Dinucleotide als Bausteine für das genetische Kopieren von RNA machen es erstmals möglich Sequenzen von bis zu 12 Basen enzymfrei in eine Kopie zu überschreiben. Dies ist für den Ursprung des Lebens von Bedeutung.
Weitere Informationen erhalten Sie von:
Prof. Clemens Richert
Institut für Organische Chemie
Universität Stuttgart
von Robert U. StelzerRobert U. Stelzer, Yuji Ikeda*, Prashanth Srinivasan, Tanja S. Lehmann, Blazej Grabowski, und Rainer Niewa
Material für die Li-Sn-Batterie für bisher höchste Kapazitäten in einer engen Kooperation zwischen experimentellen anorganischen Chemikern und Materialwissenschaftlern der theoretischen Materialsimulation entdeckt.
Weitere Informationen erhalten Sie von:
Prof. Rainer Niewa
Institut für Anorganische Chemie
Universität Stuttgart
von Hang Liu, Dr. Hongguang Wang, Dr. Qian Song, Dr. Kathrin Küster, Prof. Ulrich Starke, Dr. Peter A. van Aken und Prof. Elias Klemm
Angew. Chem.Int. Ed.2022, e202117058
Weitere Informationen erhalten Sie von:
Prof. Elias Klemm
Institut für Technische Chemie
Universität Stuttgart
Achtung: Sitzungen des Habilitationsausschusses und
des Großen Promotionsausschusses finden nur bei Bedarf statt.
12. März 2025
Kleiner Promotionsausschuss
30. April 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss
04. Juni 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss
02. Juli 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss
15. Oktober 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss, Großer Promotionsausschuss
12. November 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss
17. Dezember 2025
Großer Fakultätsrat,
Kleiner Promotionsausschuss
21. Januar 2026
Großer Fakultätsrat,
Kleiner Promotionsausschuss
https://www.f03.uni-stuttgart.de/fakultaet/#id-dcd6f845-0
Derzeit sind keine Professuren ausgeschrieben. Bitte besuchen Sie diese Seite regelmäßig für Updates zu neuen Ausschreibungen.
There are currently no professorships advertised. Please visit this page regularly for updates on new vacancies.
Die Fakultät Chemie verfügt über eine Glasbläserwerkstatt und eine mechanische Werkstatt.
Um die Belange der Werkstätten kümmert sich unsere Werkstattkommission. Der Leiter der Kommission ist Prof. Elias Klemm ITC. Weitere Mitglieder sind: Dr. Dominik Bloos IPC, Jun.-Prof. Bertold Rasche IAC, Dr. Johannes Ackermann IOC, Prof. Oliver Clemens IMW, Dr. Klaus Dirnberger IPOC und Dipl.-Ing. Ines Lauerwald ITC.
Bitte beachten Sie: Unsere Werkstätten sind nur für universitätsinterne Aufträge zuständig.
Auftragsformulare für die Werkstätten finden Sie hier (*.docx) und hier (*.pdf) verlinkt (nur für den internen Gebrauch).
Dekanatsbüro

Monika Carey
Sekretariat

Dorothea Häussermann
Dr.Fakultätsmanagerin

Isabella Waldner
Dr.Fakultätsmanagerin - abwesend von 1.10.2024 bis 30.09.2025.
Bitte wenden Sie sich an
Dr. Dorothea Häussermann